Registro sanitario: El dilema de los laboratorios farmacéuticos
Por: Grissell Medina
SANTO DOMINGO, RD/ DIARIO DE SALUD.-- Para la fabricación y comercialización de medicamentos en República Dominicana, el Ministerio de Salud Pública debe expedir un certificado de registro sanitario en un plazo de 60 a 90 días luego de la solicitud realizada por el laboratorio farmacéutico interesado.
Al menos así lo dicta la Ley General de Salud 42-01, aunque una de las quejas que siempre ha tenido la industria farmacéutica es la lentitud del proceso, que según los representantes del sector puede tardar hasta 18 meses si no se realiza por el nuevo procedimiento simplificado, implementado este año por la Dirección General de Medicamentos, Alimentos y Productos Sanitarios (Digemaps).
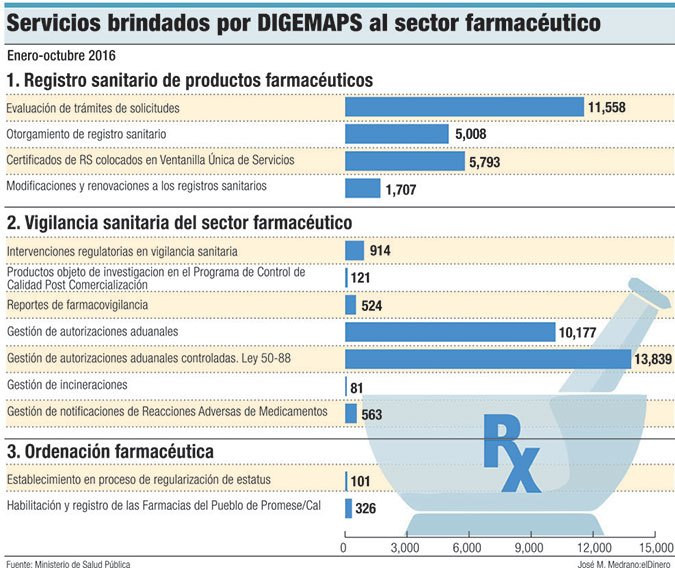
El año pasado, la entidad otorgó 5,008 registros sanitarios a productos farmacéuticos. De acuerdo con la memoria anual del Ministerio de Salud Pública, los ingresos por los registros de medicamentos, productos cosméticos y de higiene, realizados a través de la Digemaps el año pasado, representaron la mayor recaudación, con RD$81.3 millones, equivalente al 73.60% del total.
Henry Suárez, presidente ejecutivo de la Asociación de Representantes, Agentes y Productores Farmacéuticos (ARAPF), asegura que hace unos años estuvieron de acuerdo con el aumento en los precios del registro de los medicamentos, alimentos y renovaciones, con el fin de que el ministerio tuviera fondos para mejorar su plataforma tecnológica.
“Sabemos que la Digemaps ha hecho un esfuerzo, lamentablemente la plataforma que tienen es muy antigua, data de los años 90 y están en proceso de mejorarla, eso es algo que a nosotros nos parece que deben centrarse un poquito más porque el tema de los tiempos de registro sí nos afecta bastante”, explica.
Considera que aunque la ley es clara, no se implementa en su totalidad ni de manera adecuada y que el sector privado no tendría ninguna queja si las autoridades cumplieran con lo que establece.
“En este momento un registro normal de un producto que no vaya por la vía acelerada puede tardarse de 12 a 18 meses. Y esto no es un secreto para nadie, lo reconoce la Digemaps, están muy atrasados con el proceso de registro”, agrega.
Fernando Ferreira, vicepresidente ejecutivo de ARAPF, agrega que el Laboratorio Nacional Doctor Defilló tarda unos 12 meses en el análisis de las muestras, pero que con el procedimiento simplificado el proceso para obtener el registro es más rápido y tarda de 3 a 6 meses.
En tanto que Patricia Mena, vicepresidenta ejecutiva de Industrias Farmacéuticas Dominicanas, Inc. (Infadomi), entiende que el ministerio tiene algunas carencias de tecnología, recursos humanos e infraestructuras, por lo que piensa que las autoridades se deberían enfocar en atender esos puntos, “porque con una entidad reguladora fuerte, entonces podemos tener un sector fortalecido”.
Con relación al procedimiento simplificado, explica que constituye una solución solo para algunos laboratorios y productos. Por lo que considera que el ministerio debe solucionar el problema para que todos se beneficien y puedan obtener oportunamente sus registros.
Fernando Espinal, miembro de la directiva de Infadomi, señala que el proceso de registro sanitario está en proceso de mejora y que recientemente el Consejo Nacional de Competitividad comunicó que está trabajando con la Digemaps para crear una plataforma más eficiente.
Destaca que el sector privado está dispuesto a colaborar, porque les interesa que el proceso funcione de manera más fluida.
Procedimiento simplificado del registro sanitario
Escarlen Heredia, subdirectora de Digemaps, explica que mediante el procedimiento simplificado para el registro sanitario los medicamentos tienen las mismas garantías que con el proceso ordinario y que el objetivo es que los fabricantes cumplan con la nueva “Guía de Buenas Prácticas de Manufactura” de la Organización Mundial de la Salud (OMS) para la industria farmacéutica.
Asegura que a los que aplican al nuevo proceso le ofrecen una respuesta máxima de 60 días para medicamentos y productos sanitarios, mientras que para productos cosméticos y de higiene, el plazo es de 15 días.
Karina Mena, directora de Digemaps, afirma que tienen registrados 124 laboratorios de medicamentos y cosméticos que operan de forma regular en el país, siete de los cuales han solicitado el procedimiento y cinco que ya culminaron el proceso.
Explica que cuando solicitan ese procedimiento el ministerio realiza una inspección, que puede tardar hasta 5 días dependiendo del tamaño de la fábrica, y le deja las observaciones sobre los detalles que tienen que corregir para cumplir con las buenas prácticas.
Luego se realiza una segunda inspección y si cumplen con las observaciones pueden aplicar para el procedimiento.
En cuanto a los requisitos, Mercedes Soriano, encargada del Departamento de Registro Sanitario, resaltó que el ministerio solicita documentación técnica, administrativa y legal, así como las fichas técnicas, expedientes, documentos de control de calidad de los medicamentos, de la fórmula, metodología y certificados de análisis.
Asegura que muchas veces hay incongruencia en la información que se presenta, por lo que tienen que observar el expediente y notificar al usuario, que deberá corregir las faltas y reintegrar el expediente para continuar con el proceso.
Además, se evalúan las condiciones de la infraestructura donde operan los laboratorios.
Por lo general las críticas que realiza el ministerio tienen que ver con la higiene en el proceso y en las diferentes áreas de la fábrica, desde el inicio de la producción hasta el final.
Ramona Díaz, encargada de la Unidad de Buenas Prácticas de Manufacturas, afirma que hay 43 fábricas de medicamentos que trabajan con las buenas prácticas de manufacturas, mientras que a los demás les dan seguimiento hasta que las cumplan.
“Se evalúa cómo funciona el procedimiento de elaboración de un producto con la guía armonizada conforme al informe 32 de la Organización Mundial de la Salud, una guía compleja que abarca todas las áreas, desde garantía de calidad y producción, y eso permite mejorar mucho las condiciones de fabricación nacional”, añade.
Medicamentos importados
Karina Mena señala que para otorgar el registro sanitario a los medicamentos importados se verifica que el fabricante cumpla con las buenas prácticas de producción de su país y que tenga un certificado de venta libre emitido por la autoridad correspondiente.
“Para poder autorizar el registro sanitario de un producto importado tiene que cumplir con las mismas garantías de seguridad, calidad y eficacia que los productos locales”.
Agregó que iniciaron un proceso de transformación del sistema de vigilancia sanitaria y que están realizando un control post-comercialización. “Cuando los productos están en el mercado tomamos muestras, las llevamos al laboratorio y podemos verificar las concentraciones, los aspectos microbiológicos, la potencia, conforme a lo que está registrado”.
Dependiendo la cantidad que se importa, el inspector también puede ir junto a la mercancía al destino en el que se va a almacenar y verificar las condiciones de almacenamiento.
“Hemos hecho un esfuerzo por mejorar los canales de importación, todo lo que ingresa estamos autorizando todas las facturas manual para que pueda entrar por nuestras aduanas y tenemos un nuevo sistema de inspección a nivel de puntos de entrada para todo el que ingrese a territorio nacional, que incluye la autorización de las materias primas que utilizan los laboratorios de producción nacional”, indica Mena.
Según la memoria de 2016, la institución cuenta con 21 técnicos ubicados en seis puntos de control de entrada al país, quienes inspeccionan los medicamentos que ingresan por los puertos, aeropuertos y pasos fronterizos.
También tiene siete inspectores en el Aeropuerto Internacional Las Américas (Aila) revisan si en las maletas de los pasajeros entran medicamentos de manera irregular.
Fármaco-vigilancia
De acuerdo con Karina Mena, directora de Digemaps, esa entidad realiza inspecciones ordinarias y extraordinarias. Las ordinarias se requieren por las buenas prácticas de manufactura que deben renovarse cada año y si no lo hacen detienen los procesos vinculados con la dirección, la expedición de los registros sanitarios, la autorización de importación de materias primas y de productos terminados.
En esas revisiones, la entidad ha encontrado fallas en los sistemas de agua, aire, infraestructuras y en los procedimientos que se utilizan para la fabricación de los fármacos.
Dependiendo del nivel de las observaciones, los técnicos deben volver hasta que el laboratorio complete los requerimientos. En caso de que sea una falta grave, como problemas en el sistema de agua para productos inyectables, puede detener la producción. Pero si la falla se relaciona con la documentación, le otorgan un plazo para que la corrijan y si no lo hacen, entonces cierran la fábrica para que no pueda seguir operando.
Los medicamentos importados también deben tener su registro sanitario al día y colocar en la factura aduanal los lotes, la fecha de vencimiento, las cantidades y el destino final.

Escribe tu comentario